Eine freie Initiative von Menschen bei mit online Lesekreisen, Übungsgruppen, Vorträgen ... |
| Use Google Translate for a raw translation of our pages into more than 100 languages. Please note that some mistranslations can occur due to machine translation. |
Katalysator

Ein Katalysator (von griech. κατάλυσις katálysis „Auflösung“) ist ein Stoff, der - bereits in kleinen Mengen beigegeben - eine chemische Reaktion durch Senkung der dafür benötigten Aktivierungsenergie beschleunigt. Der Katalysator beteiligt sich an der Reaktion, indem er eine energieärmere Zwischenverbindung mit den reagierenden Stoffen eingeht und dadurch die Aktivierungsenergie verringert. Nach Ablauf der Reaktion wird der Katalysator unverändert freigesetzt und steht für weitere Katalysezyklen wieder zur Verfügung. Dieser Vorgang wird als Katalyse bezeichnet. Insgesamt verändert der Katalysator nur die Kinetik der chemischen Reaktion, nicht aber deren Thermodynamik, d.h. die Energie, die durch die Reaktion insgesamt erzeugt oder verbraucht wird, bleibt unverändert.
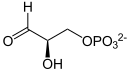
Biochemische Prozesse laufen stets nur in Anwesenheit eines meist sehr komplex gebauten Katalysators, eines sog. Enzyms, in nennenswerter Geschwindigkeit ab. So katalysiert etwa das Enzym Triosephosphatisomerase (TIM, TPI) in einem Teilschritt der Glycolyse, dem lebenswichtigen Zuckerabbau in allen Organismen, die Umwandlung von Dihydroxyacetonphosphat (DHAP) zu Glycerinaldehyd-3-phosphat (GAP):
Siehe auch
- Katalysator - Artikel in der deutschen Wikipedia
- Katalyse - Artikel in der deutschen Wikipedia