imported>Joachim Stiller |
imported>Odyssee |
| Zeile 1: |
Zeile 1: |
| {| class="wikitable float-right" style="text-align:left; font-size:90%;" width="10%"
| | [[Datei:Natriumexplosion.jpg|mini|250px|Explosive Reaktion von [[Natrium]] und [[Wasser]]]] |
| |- class="hintergrundfarbe6" | | [[Datei:ThermiteFe2O3.JPG|mini|250px|[[Wikipedia:Thermitreaktion|Thermitreaktion]] von [[Wikipedia:Eisen(III)-oxid|Eisen(III)-oxid]] und [[Aluminium]]]] |
| ! Polymere (Beispiele)
| | [[Datei:Triosephosphate isomerase.jpg|mini|250px|Bändermodell des Enzyms [[Wikipedia:Triosephosphatisomerase|Triosephosphatisomerase]] (TIM, TPI) nach {{PDB|2jk2}} ]] |
| |- class="hintergrundfarbe2" | | [[Datei:Energiediagramm-Enzymreaktion.svg|mini|250px||Energiediagramm der Enzym-Katalyse: Die Aktivierungsenergie (freie Aktivierungsenthalpie) wird im Vergleich zu unkatalysierten Reaktionen durch Stabilisierung des Übergangszustandes gesenkt. Die freie [[Wikipedia:Reaktionsenthalpie|Reaktionsenthalpie]] bleibt dabei unverändert.]] |
| | [[Datei:Polypropylene.svg|zentriert|120px]] Die sich [[Konstitutionelle Repetiereinheit|wiederholende Einheit]] des Polymers [[Polypropylen]].
| |
| |- class="hintergrundfarbe2" | |
| | [[Datei:Cellulose Sessel.svg|zentriert|230px]] [[Cellulose]] ist ein Polymer und das wichtige Strukturelement der Pflanzen.
| |
| |}
| |
|
| |
|
| Ein '''Polymer''' [{{IPA|poliˈmeːɐ̯}}] (von {{grcS|πολύ}}, ''polý'' ‚viel‘ und {{lang|grc|μέρος}}, ''méros'' ‚Teil‘) ist ein [[chemischer Stoff]], der aus [[Makromolekül]]en besteht.<ref>{{Gold Book| polymer|P04735|Version=2.3.3}}</ref> Die Makromoleküle eines Stoffes sind aus einer oder mehreren Struktureinheiten, den sogenannten [[Konstitutionelle Repetiereinheit|konstitutionellen Repetiereinheiten]] oder Wiederholeinheiten, aufgebaut. Das Adjektiv ''polymer'' bedeutet entsprechend „aus vielen (gleichen) Teilen aufgebaut“. In vielen Fällen besteht ein Polymer aus nicht identischen Makromolekülen, da die Anzahl der Wiederholeinheiten und damit die [[Molekülmasse]] der [[Molekül]]e variiert. Synthetische oder halbsynthetische Polymere sind die Hauptkomponente für die Herstellung von [[Kunststoff]]en. Von Lebewesen erzeugte Polymere werden [[Biopolymer]]e genannt und haben essentielle Bedeutung für das Leben.
| | Eine '''chemische Reaktion''' ist ein [[Chemie|chemischer]] [[Prozess]], bei dem ein oder mehrere [[Chemisches Element|chemische Elemente]] oder [[chemische Verbindungen]] in andere chemische [[Stoff]]e umgewandelt werden. Dabei wird [[Energie]] z.B. in Form von [[Wärme]] und/oder [[Licht]] abgegeben oder verbraucht, die sog. '''[[Wikipedia:Reaktionsenthalpie|Reaktionsenthalpie]]''' ({{ELSalt|ἐν}} ''en'' „in“ und {{polytonisch|θάλπειν}} ''thálpein'' „erwärmen“): <math>\Delta H_\mathrm{R} = H_\mathrm{Produkte} - H_\mathrm{Edukte}</math> |
|
| |
|
| == Einteilung == | | == Aktivierungsenergie == |
| Polymere können in ''natürliche'' und ''synthetische'' Polymere unterteilt werden.
| | [[Datei:Streichholz.jpg|mini|left|Ein entzündetes Streichholz]] |
| * Natürliche Polymere ([[Biopolymer]]e) werden in Lebewesen synthetisiert und bilden die Grundbausteine der Organismen. Zu diesen Polymeren zählen die [[Protein]]e, sie bilden beispielsweise [[Haar]]e und die [[Seide]]. Zu den [[Polysaccharide]]n gehören [[Zellulose]], [[Stärke]] und [[Chitin]]. [[Nukleinsäuren]] erfüllen viele biologische Funktionen, wie [[Desoxyribonukleinsäure]] als Erbsubstanz.
| | Damit eine Reaktion überhaupt in Gang kommt, ist die Zufuhr einer entsprechenden '''Aktivierungsenergie''' notwendig. So kann man etwa ein [[Wikipedia:Streichholz|Streichholz]] nur entzünden, wenn man ihm durch Reibung mechanische Energie bzw. Wärmeenergie zuführt. Bei scheinbar spontan ablaufenden Reaktionen wird die nötige [[Energie]] unmittelbar der Umgebungswärme entnommen. Je höher die zugeführte Wärme bzw. je geringer die benötigte Aktivierungsenergie ist, desto schneller läuft die Reaktion ab. Durch Beigabe kleiner Mengen eines spezifischen [[Katalysator]]s, der die nötige Aktivierungsenergie verringert, kann die Reaktion gegebenenfalls wesentlich beschleunigt werden. |
| * Synthetische Polymere sind durch [[Polyreaktion]]en industriell oder im Labormaßstab hergestellte Stoffe, dazu gehören [[Polyethylen]], [[Polystyrol]] und [[Polyvinylchlorid]]. Chemisch modifizierte Polymere entstehen durch die Weiterverarbeitung von Biopolymeren, beispielsweise [[Nitrocellulose]], [[Celluloid]] oder Stärkederivate.
| |
|
| |
|
| Polymere können nach der Anzahl der Grundstoffe ([[Monomer]]e), aus denen sie aufgebaut sind, eingeteilt werden.
| | == Beispiele == |
| | Eine einfache chemische Reaktion ist beispielsweise die [[Verbrennung]], bei der ein brennbarer Stoff mit dem [[Sauerstoff]] ([[lat.]] ''Oxygenium''; abgeleitet von {{ELSalt|ὀξύς}} ''oxys'' „scharf, spitz, sauer“ und {{polytonisch|γεν-}} ''gen-'' „erzeugen“) der [[Luft]] unter Energieabgabe reagiert. So entsteht etwa bei der Verbrennung von [[Kohlenstoff]] mit einer ausreichenden Menge Sauerstoff das gasförmige [[Wikipedia:Kohlendioxid|Kohlendioxid]] (bzw. bei Sauerstoffmangel das sehr giftige [[Wikipedia:Kohlenmonoxid|Kohlenmonoxid]]): |
|
| |
|
| * [[Homopolymer]]e bestehen aus nur einer Monomerart wie [[Polyethylen]], [[Polypropylen]], [[Polyvinylchlorid]] oder [[Polycaprolactam]]. Ein natürliches Homopolymer ist [[Naturkautschuk]] als ein [[Polyisopren]].
| | :<math>\mathrm{C\ +\ O_2 \longrightarrow \ CO_2 \ ; \quad \Delta} H = -394 \; \mathrm{kJ/mol}</math><ref>''Schülerduden Chemie'', Bibliografisches Institut & F.A. Brockhaus AG, Mannheim 2007, ISBN 978-3-411-05386-5, S. 195.</ref> |
| * [[Copolymer]]e sind aus verschiedenen Monomeren aufgebaut, wie [[Acrylnitril-Butadien-Styrol]]-Copolymer (ABS), [[Styrol-Acrylnitril]] (SAN) oder [[Butylkautschuk]]. Die meisten Biopolymere sind Copolymere.
| |
| * [[Polymerblend]]s entstehen durch Mischen von unterschiedlichen Homopolymeren und/oder Copolymeren.<ref>{{Gold Book|Polymer Blend|P04736|Version=2.3.1}}</ref> Hergestellt werden sie meist durch intensive mechanische Vermischung von geschmolzenen Polymeren, wobei sich ein homogenes Material ergibt. Eine besondere Form eines Blends ist eine [[Polymerlegierung]].
| |
|
| |
|
| Außerdem lassen sich ''organische'' von ''anorganischen'' Polymeren unterscheiden. Anorganische Polymere enthalten im Gegensatz zu den organischen Polymeren keine Kohlenstoffatome in der [[Backbone (Biochemie)|Hauptkette]] des Polymers. Zu den anorganischen Polymeren zählen [[Polysiloxane]], [[Polyphosphazene]] oder [[Polysilazane]]. Während [[Glas|Gläser]] in den meisten chemischen Lehrbüchern nicht zu den Polymeren gezählt werden, gelten Gläser und teilweise auch [[Keramik]] und [[Basalt]] in anderen Lehrbüchern<ref name="Elias">Hans-Georg Elias: ''Makromoleküle.'' John Wiley & Sons, 2003, ISBN 978-3-527-62654-0. Band 4, S. 165.</ref> und in der [[Textiltechnik]] als anorganische Polymere.<ref name="Cherif">Chokri Cherif (Hrsg.): ''Textile Werkstoffe für den Leichtbau'' Springer-Verlag, Berlin/Heidelberg 2011, ISBN 978-3-642-17991-4, S. 14f.</ref><ref name="Fuchs">Hilmar Fuchs, Wilhelm Albrecht (Hrsg.): ''Vliesstoffe - Rohstoffe, Herstellung, Anwendung, Eigenschaften, Prüfung.'' 2. Auflage, Wiley-VCH Verlag, Weinheim 2012, ISBN 978-3-527-31519-2, S. 42.</ref><ref name="Bobeth">Wolfgang Bobeth (Hrsg.): ''Textile Faserstoffe. Beschaffenheit und Eigenschaften''. Springer-Verlag, Berlin/Heidelberg/New York 1993, ISBN 3-540-55697-4, Arten textiler Faserstoffe in Abb. 1.1; s. hinterer Vorsatz</ref>
| | Eine anderes Beispiel ist die rechts im Bild gezeigte stark exotherme [[Wikipedia:Thermitreaktion|Thermitreaktion]] von [[Wikipedia:Eisen(III)-oxid|Eisen(III)-oxid]] und [[Aluminium]], bei der Temperaturen bis über 2000 °C erreicht werden: |
|
| |
|
| == Synthetische Polymere == | | :<math>\mathrm{Fe_2O_3 + 2 \ Al \longrightarrow Al_2O_3 + 2 \ Fe; \quad \Delta} H = -851{,}5 \; \mathrm{kJ/mol}</math> |
| === Polymerchemie ===
| |
| Die Bildung von Polymeren aus einzelnen Monomeren erfolgt über verschiedene Arten von [[Polyreaktion]]en, wie [[Kettenpolymerisation]]en, [[Polykondensation]] oder [[Polyaddition]].
| |
|
| |
|
| === Struktur von Polymeren ===
| | Das Bild rechts oben zeigt die Reaktion von metallischem [[Natrium]] mit [[Wasser]]. Das bei der Reaktion gebildete [[Wasserstoff]]gas entzündet sich, verbrennt explosionsartig und reißt geschmolzene Natriumtröpfchen mit, die zu [[Wikipedia:Natriumoxid|Natriumoxid]] bzw. [[Wikipedia:Natriumperoxid|Natriumperoxid]] verbrennen: |
| Die sich bei der Synthese bildenden Makromoleküle haben unterschiedliche Grundstrukturen, die die physikalischen Eigenschaften des Polymers bestimmen. Es können sich lineare Makromoleküle bilden, die nur aus einer Polymerkette ([[Backbone (Biochemie)|Hauptkette]]) bestehen. Im Fall von [[Polyethylen]] ist die Hauptkette ein langkettiges [[Alkane|''n''-Alkan]]. Je nach Reaktionsbedingungen bilden sich auch verzweigte Makromoleküle mit einer Hauptkette auch [[Seitenkette]]n, bei Polyethylen wären es [[Alkylgruppe|Alkylreste]].
| |
| Neben der Kettenlänge bestimmt auch der Verzweigungsgrad Dichte, Festigkeit und Schmelzpunkt des Polymers. Hochverzweigte Polymere sind [[Amorphes Material|amorph]], die Moleküle im Feststoff wechselwirken ungeordnet miteinander. Besonders unverzweigte Makromoleküle bilden als Feststoff eine [[Kristallisation (Polymer)|teilkristalline Struktur]], in der Abbildung unten rot markiert. Während verzweigte und unverzweigte Polymere in der Regel [[Thermoplast]]e sind, liegen bei vielen [[Elastomer]]en eine weitmaschige [[Vernetzung (Chemie)|Vernetzung]] zwischen den „Hauptketten“ vor. Eine engmaschige Vernetzung führt hingegen zu [[Duroplast]]en. Vernetzungen und Verzweigungen sind in den Abbildungen als rote Punkte dargestellt.
| |
|
| |
|
| :{| class="wikitable" style="text-align:center; font-size:90%;" width="60%" | | :<math>\mathrm{2 \ Na + 2 \ H_2O \rightarrow 2 \ NaOH + H_2}; </math> |
| |- class="hintergrundfarbe2"
| | :<math>\mathrm{4\ Na + O_2 \longrightarrow 2\ Na_2O;} {\quad \Delta} H = -431{,}6 \; \mathrm{kJ/mol}</math> |
| | [[Datei:Polymerstruktur-linear.svg|130px]]<br /> lineares Makromolekül
| | :<math>\mathrm{2\ Na_2O + O_2 \longrightarrow 2\ Na_2O_2;} {\quad \Delta} H = -79{,}6 \; \mathrm{kJ/mol}</math> |
| | [[Datei:Polymerstruktur-verzweigt.svg|130px]]<br /> verzweigtes Makromolekül
| |
| | [[Datei:Polymerstruktur-teilkristallin.svg|150px]]<br />teilkristalline Struktur linearer Polymere
| |
| | [[Datei:Polymerstruktur-weitmaschig vernetzt.svg|130px]]<br /> weitmaschig vernetztes Polymer
| |
| | [[Datei:Polymerstruktur-engmaschig vernetzt.svg|130px]]<br /> engmaschig vernetztes Polymer
| |
| |}
| |
|
| |
|
| Polymere, die aus nur einer (realen oder gedachten) Monomerart aufgebaut sind, werden [[Homopolymer]]e genannt. Polymere, die aus zwei oder mehr unterschiedlichen Monomerarten hergestellt werden, sind [[Copolymere]]. Polymere wie [[Polyethylenterephthalat]], die zwingend aus zwei verschiedenen Monomeren hergestellt werden, werden meist als Homopolymere betrachtet, da sich jeweils nur eine charakteristische Wiederholeinheit ausbilden kann.
| | === Wöhlers Harnstoffsynthese (1828) === |
|
| |
|
| :{| class="wikitable" style="text-align:left; font-size:90%;" width="80%"
| | Als es dem [[Wikipedia:Deutschland|deutschen]] [[Chemiker]] [[Wikipedia:Friedrich Wöhler|Friedrich Wöhler]] (1800-1882) erstmals [[Wikipedia:1828|1828]] gelang, [[Harnstoff]] aus der salzartigen [[Anorganische Verbindung|anorganischen Verbindung]] [[Wikipedia:Ammoniumcyanat|Ammoniumcyanat]] herzustellen, galt dies als Beweis, dass die Synthese organischer Verbindungen keiner besonderen „[[Lebenskraft]]“ bedürfe: |
| |-
| |
| | class="hintergrundfarbe6" align="center" colspan="4" |Homo- und Copolymere (Beispiele)
| |
| |- style="vertical-align:top" class="hintergrundfarbe2"
| |
| | [[Datei:Polystyrene skeletal.svg|80px|zentriert]]
| |
| | [[Datei:Poly(dimethylsiloxan).svg|100px|zentriert]]
| |
| | [[Datei:Styrol-Butadien-Kautschuk.svg|180px|zentriert]]
| |
| | [[Datei:PET.svg|200px|zentriert]]
| |
| |- style="vertical-align:top"
| |
| | Homopolymer [[Polystyrol]]: Eine [[Konstitutionelle Repetiereinheit]], die sich ''n''-fach im Makromolekül wiederholt.
| |
| | Homopolymer [[Polydimethylsiloxan|Poly(dimethylsiloxan)]], ein [[Silikone|Silikon]]. Die [[Backbone (Biochemie)|Hauptkette]] wird von Silicium- und Sauerstoffatomen gebildet. | |
| | Copolymer [[Styrol-Butadien-Kautschuk]]: Die Monomeren [[Styrol]] und [[1,3-Butadien]] bilden zwei Konstitutionelle Repetiereinheiten, die sich nach der Abbildung in beliebiger Reihenfolge in einem Makromolekül abwechseln können.
| |
| | [[Polyethylenterephthalat]] hat nur eine charakteristische Konstitutionelle Repetiereinheit, obwohl zur Synthese zwei Monomere eingesetzt werden müssen.
| |
| |}
| |
|
| |
|
| Bei Copolymeren lassen sich über Syntheseweg die Abfolge der konstitutionellen Repetiereinheiten lenken. Es wird in statistische und alternierende Copolymere, Blockcopolymere, Pfropfcopolymer und Gradientcopolymere unterteilt. In der Abbildung unten werden schematisch Bipolymere dargestellt, Ⓐ und Ⓑ symbolisieren die beiden Repetiereinheiten.
| | :<math>\mathrm{AgNCO + NH_4Cl \rightarrow NH_4(NCO) + AgCl}</math> |
|
| |
|
| :{| class="wikitable" style="text-align:center; font-size:90%;"
| | Wöhler erkannte dabei ganz richtig, dass die intermediär gebildete Verbindung [[Wikipedia:Ammoniumcyanat|Ammoniumcyanat]] (NH<sub>4</sub>NCO) die eigentliche Harnstoffquelle darstellte: |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Statistical copolymer 3D.svg|270px|Statistisches Copolymer]]<br /> Statistisches Copolymer
| |
| | [[Datei:Gradient copolymer 3D.svg|270px|Gradientcopolymer]]<br /> Gradientcopolymer
| |
| | rowspan="2" | [[Datei:Graft copolymer 3D.svg|270px|Pfropfcopolymer]]<br /> Pfropfcopolymer
| |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Alternating copolymer 3D.svg|270px|Alternierendes Copolymer]]<br /> Alternierendes Copolymer
| |
| | [[Datei:Block copolymer 3D.svg|250px|Blockcopolymer]]<br /> Blockcopolymer
| |
| |}
| |
|
| |
|
| Repetiereinheiten können [[Substituent]]en („Reste“) tragen und werden in Abbildungen häufig mit dem Buchstaben R gekennzeichnet. Sind die Monomereinheiten asymmetrisch, tritt eine [[Taktizität]] der Anordnungen im Makromolekül auf. Die Polymere lassen sich in ataktische, isotaktische und syndiotaktische Polymere unterteilen. Ein Beispiel für Taktizitäten ist Polystyrol mit einer [[Phenylgruppe]] als Rest. Während der klassische Syntheseweg zu ataktischen, amorphen Kunststoffen führt, ergibt eine syndiotaktische Synthese ein kristallines Polystyrol mit wirtschaftlich steigender Bedeutung.
| | : [[Datei:Urea Synthesis Woehler.png|ohne|300px|Harnstoffsynthese nach Wöhler]] |
|
| |
|
| :{| class="wikitable" style="text-align:center; font-size:90%;" width="60%"
| | === Biochemische Reaktionen === |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Isotactic-A-2D-skeletal.png|240px]]<br /> isotaktisch
| |
| | [[Datei:Syndiotactic-2D-skeletal.png|280px]]<br /> syndiotaktisch
| |
| | [[Datei:Atactic-2D-skeletal.png|240px]]<br /> ataktisch
| |
| |}
| |
|
| |
|
| Bei Polymeren, die in der Hauptkette [[Ungesättigte Verbindungen|ungesättigt]] sind, tritt in Analogie zur [[cis-trans-Isomerie|''cis''-''trans''-Isomerie]] ''cis''- oder ''trans''-taktische Polymere auf, wie bei [[Naturkautschuk]] oder auch [[Butadien-Kautschuk]]. Stereospezifische Polymerisationen führen oft zu höherer mechanischer Festigkeit, höherer Kristallinität, höherer Dichte und höhere Wärmestabilität.
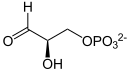
| | [[Biochemie|Biochemische]] Prozesse, die für den [[Stoffwechsel]] aller [[Lebewesen]] von zentraler Bedeutung sind, laufen stets nur in Anwesenheit eines meist sehr komplex gebauten Katalysators in nennenswerter Geschwindigkeit ab. So katalysiert etwa das Enzym [[Wikipedia:Triosephosphatisomerase|Triosephosphatisomerase]] (TIM, TPI) in einem Teilschritt der [[Wikipedia:Glycolyse|Glycolyse]], dem lebenswichtigen [[Zucker]]abbau in allen [[Organismen]], die Umwandlung von [[Wikipedia:Dihydroxyacetonphosphat|Dihydroxyacetonphosphat]] (DHAP) zu [[Wikipedia:Glycerinaldehyd-3-phosphat|Glycerinaldehyd-3-phosphat]] (GAP): |
|
| |
|
| :{| class="wikitable" style="text-align:left; font-size:90%;" width="70%"
| | [[Datei:Dihydroxyacetonphosphat Skelett.svg|140px]] <math>\rightleftharpoons</math> [[Datei:D-Glycerinaldehyd-3-phosphat Skelett.svg|130px]] |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Cis-1,4-Polybutadiene V.1.png|270px|zentriert]]<br /> Ausschnitt aus einer Polymerkette von ''cis''-1,4-[[Polybutadien]]. Eine C<sub>4</sub>-Einheit ist <span style="color:blue;">'''blau'''</span> markiert.
| |
| | [[Datei:Trans-1,4-Polybutadiene V.2.svg|270px|zentriert]]<br /> Ausschnitt aus einer Polymerkette von ''trans''-1,4-Polybutadien. Eine C<sub>4</sub>-Einheit ist <span style="color:blue;">'''blau'''</span> markiert.
| |
| |}
| |
| | |
| === Festkörperstrukturen ===
| |
| Die makroskopischen physikalischen Eigenschaften eines Polymers sind eng mit den Wechselwirkungen der Polymerketten untereinander verknüpft.
| |
| | |
| {| class="wikitable float-right" style="text-align:center; font-size:90%;" width="30%"
| |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Statistischer Kneul.svg|100px]]<br /> Statistischer Knäul
| |
| | [[Datei:Verhakungen.svg|200px]]<br />Verhakungen mehrerer Moleküle mit knäulartigen Teilstrukturen
| |
| |}
| |
| | |
| * Ataktische Polymere, Polymere mit einem hohen [[Verzweigungsgrad]] und statistische Copolymere bilden im festen Zustand [[Amorphes Material|amorphe]], glasartige Strukturen aus.<ref name="MakroChem">Bernd Tieke: ''Makromolekulare Chemie.'' 3. Auflage, Wiley-VCH, Weinheim 2014, S. 295f.</ref> In Schmelze und Lösung bilden langkettige Moleküle tendenziell einen sich ständig ändernden „statistischen Knäuel“ aus, siehe [[Frei bewegliche Kette|Gaußkette]] (Freely-Jointed-Chain-Modell). Im festen Zustand wird die jeweiligen [[Konformation]]en der Moleküle eingefroren. Verhakungen und [[Verschlaufung]]en von Kettenmolekülen untereinander führen zu einer „mechanischen Bindung“ zwischen den Ketten. Zwischenmolekulare und [[intramolekular]]e [[Zwischenmolekulare Kräfte|Nebenvalenzbindungen]] treten nur an Stellen auf, an denen Molekülsegmente nahe genug aneinander liegen. Die unregelmäßige Strukturen der Moleküle verhindert eine engere Anordnung. Solche Anordnungen werden gelegentlich „Spaghettistruktur“ genannt.
| |
| | |
| {| class="wikitable float-right" style="text-align:center; font-size:90%;" width="30%"
| |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Polyethylene-xtal-view-down-axis-3D-balls-perspective.png|180px]]<br />Polyethylen: Zickzack-Konformation der Moleküle in dichten Kettenpackungen
| |
| | [[Datei:Lamellen.svg|180px]]<br /> Lamellen mit Tie-Molekülen
| |
| | [[Datei:Spherulite2de.svg|180px]]<br /> Sphärolith
| |
| |}
| |
| {| class="wikitable float-right" style="text-align:center; font-size:90%;" width="30%"
| |
| |- class="hintergrundfarbe2"
| |
| | [[Datei:Helix-Polypropylen.svg|100px]]<br />Helix
| |
| | [[Datei:P-Aramid H-Brücken.svg|200px]]<br />[[Aramide|''p''-Aramid]], rot gepunktet: Wasserstoffbrückenbindungen
| |
| |}
| |
| | |
| * Lineare Polymere mit regelmäßigem Aufbau, mit geringer Verzweigung und stereoreguläre (iso- und syndiotaktische) Polymere haben im festen Zustand eine [[teilkristallin]]e Struktur.<ref name="MakroChem" /> Bei einfach strukturierten Polymeren, wie bei [[Polyethylen]], liegen in einer idealisierten Vorstellung weite Bereiche nicht als Knäuel, sondern in Zickzack-Konformation vor. Mehrere Zickzack-Konformationen bilden dichte Kettenpackungen aus und sind damit in diesen Bereichen kristallin. Solche [[Kristallit]]e werden Lamellen genannt und sind viel dünner (oft etwa 10 nm)<ref name="KunstChemIng">[[Wolfgang Kaiser (Chemiker)|Wolfgang Kaiser]]: ''Kunststoffchemie für Ingenieure.'' 3. Auflage, Carl Hanser, München 2011, S. 84.</ref> als die Polymere lang sind. Sie werden durch mehr oder weniger regulärer Faltungen einer oder mehrere Molekülketten gebildet. Zwischen den Lamellen liegen amorphe Strukturen vor. Einzelne Moleküle können zwischen den Lamellen zu Verschlaufungen führen, aber auch an der Bildung von zwei (oder mehr) Lamellen beteiligt sein (Tie-Moleküle). Mehrere Lamellen bilden eine Überstruktur, einen [[Sphärolith]], oft mit einem Durchmesser im Bereich von 0,05 bis 1 mm.<ref name="KunstChemIng" />
| |
| : Art und Anordnung von (funktionellen) Resten der Wiederholeinheiten beeinflussen oder bestimmen die Kristallinität und die Stärke der Nebenvalenzbindungen mit. Bei isotaktischem Polypropylen bilden die Moleküle eine [[Helix]]. Helices erlauben, wie bei einer Zickzack-Konformation, eine dichte Kettenpackung. Besonders kräftige intermolekulare Wechselwirkungen treten auf, wenn die Reste der Wiederholeinheiten die Ausbildung [[Wasserstoffbrückenbindung]]en erlauben, wie beispielsweise bei [[Aramide|''p''-Aramid]]. Die Kristallinität und Überstruktur ist immer abhängig von den Bedingungen ihrer Bildung, siehe auch [[Kristallisation (Polymer)|Kristallisation von Polymeren]]. Teilkristalline Strukturen führen im Vergleich zu amorphen Strukturen zu einer höheren Steifigkeit, Dichte, Schmelztemperatur und Beständigkeit eines Polymers.
| |
| | |
| * Weitmaschig [[Vernetzung (Chemie)|vernetzte]] Polymere sind Elastomere und lassen sich nicht wie Thermoplaste ohne Zersetzung schmelzen. [[Thermoplastische Elastomere]] sind hingegen reversibel über Nebenvalenzen „physikalisch vernetzt“ und lassen sich schmelzen. Eine Variante sind Blockcopolymere, bei dem ein Hartsegment des Polymers die Neigung zur Kristallisation hat und einem Weichsegment mit amorpher Struktur. Die Hartsegmente sorgen für eine weitmaschige, physikalische Vernetzung.
| |
| | |
| {| class="wikitable centered" style="text-align:center; font-size:90%;" width="80%"
| |
| |- class="hintergrundfarbe2" valign="top"
| |
| | [[Datei:Polymerstruktur-weitmaschig vernetzt.svg|130px]] <br /> weitmaschig vernetztes Polymer
| |
| | [[Datei:Polymerstruktur-weitmaschig vernetzt-gestreckt.svg|270px]] <br /><br /> weitmaschig vernetztes Polymer unter Zuglast
| |
| | [[Datei:Polymerstruktur-TPE-teilkristallin.svg|140px]] <br /> Kristallite als „Vernetzung“: eine Variante eines thermoplastischen Elastomers
| |
| | [[Datei:Polymerstruktur-TPE-teilkristallin gestreckt.svg|250px]] <br /><br /> teilkristallines thermoplastisches Elastomer unter Zuglast
| |
| |}
| |
| | |
| === Polymerphysik ===
| |
| {{Hauptartikel|Polymerphysik}}
| |
| Die Einteilung der Polymerwerkstoffe erfolgt nach DIN 7724 aufgrund des Temperaturverlaufes des Schubmoduls und des Zugverformungsrestes bei Raumtemperatur. Sie beruht auf dem mechanischen Verhalten im Gebrauchstemperaturbereich und der Existenz eines Schmelzbereiches (Fließbereiches):
| |
| # [[Duroplast]]e
| |
| # [[Elastomer]]e
| |
| # [[Thermoplast]]e
| |
| # [[Thermoplastische Elastomere]]
| |
| | |
| In der [[Polymerphysik]] beschäftigt man sich unter anderem mit
| |
| * [[Mittlere Molmasse]], [[Molmassenverteilung]]
| |
| * Kristallisation und Kristallisationskinetik
| |
| * Oberflächeneigenschaften von Polymeren
| |
| * [[Rheologie]], also dem Fließverhalten und der Viskosität
| |
| | |
| === Temperaturbeständige Polymere ===
| |
| {{Hauptartikel|Hochleistungskunststoffe}}
| |
| Die [[Temperaturbeständigkeit]] eines Polymers hängt von der Struktur der verwendeten Monomere, der Stabilität der Bindungen zwischen den Monomeren und den Wechselwirkungen der Polymerketten untereinander ab. Eine hohe Wärmebeständigkeit kann durch eine Erhöhung der [[Schmelzenthalpie]] und eine Erniedrigung der [[Schmelzentropie]] erreicht werden. Bei [[Amorphes Material|amorphen]] Polymeren sollten die [[Glastemperatur]] und bei [[teilkristallin]]en Polymeren die Glas- und Schmelztemperatur möglichst hoch sein. Zum Erreichen von Temperaturbeständigkeit können C-H-Bindungen und C-C-Bindungen durch [[Chemische Bindung|Bindungen]] zwischen Kohlenstoff und Heteroatomen wie Fluor, Stickstoff oder Sauerstoff oder aber durch stabilere [[Aromaten|aromatische]] Bindungen ersetzt werden. Eine weitere Möglichkeit ist der Aufbau von Polymeren mit zwei parallelen und miteinander verbundenen [[Hauptkette]]n (Leiterpolymere).<ref name="Cheldron">Harald Cherdron, Friedrich Herold, Arnold Schneller: ''Technisch wichtige temperaturbeständige Polymere.'' In: ''Chemie in unserer Zeit.'' 23, 1989, S. 181–192, [[doi:10.1002/ciuz.19890230602]].</ref>
| |
| | |
| === Leitfähige Polymere ===
| |
| {{Hauptartikel|Leitfähige Polymere}}
| |
| {{Hauptartikel|Organische Elektronik}}
| |
| | |
| {{Quellen}}
| |
| | |
| Eine Voraussetzung für die [[elektrische Leitfähigkeit]] von Polymeren ist das Vorhandensein von konjugierten [[Pi-Elektronensystem]]en. Allerdings sind solche Polymere zunächst immer noch Isolatoren, bestenfalls Halbleiter. Die Leitfähigkeit, vergleichbar mit der von metallischen Leitern, setzt erst dann ein, wenn die Polymere oxidativ oder reduktiv [[Dotierung|dotiert]] werden. Die ersten Untersuchungen hierzu erfolgten am [[Polyacetylen]], dessen Leitfähigkeit über die Dotierung mit [[Arsenpentafluorid]] oder [[Iod]] erreicht wurde. Außerdem steigt die Leitfähigkeit mit zunehmender [[Kristall]]inität des Polymers. Weitere Beispiele für leitfähige Polymere sind dotiertes [[Polypyrrol]], [[Polyphenylensulfid]], [[Polythiophen]] sowie metallorganische [[Komplexchemie|Komplexe]] mit [[Makrocyclische Verbindungen|makrocyclischen]] Liganden wie [[Phthalocyanin]].
| |
| Eine oxidative Dotierung erreicht man mit Arsenpentafluorid, [[Titantetrachlorid]], Brom oder Iod, eine reduktive Dotierung dagegen mit [[Natrium]]-[[Kalium]]-Legierungen oder Dilithiumbenzophenonat. Beim Dotieren entstehen Ladungen auf den Polymerketten, die durch die π-Konjugation über die Ketten delokalisiert sind. Die Erklärung für die Leitfähigkeit von Polymeren ist allerdings sehr komplex. So hat man versucht, den Ladungstransport entlang einer [[Polyene|Polyenkette]] mit dem [[Soliton]]-Konzept bzw. mit dem Modell der Bipolaronen (auf einem kleinen Raum zusammengehaltene Ladungspaare) zu beschreiben.
| |
| | |
| Leitende, also elektrisch aktive Polymere werden zum Aufbau von polytronischen Anwendungen verwendet. Anders als in der [[Molekularelektronik]] wird die Information nicht in einzelnen Molekülen, sondern in verschieden dotierten Volumina verarbeitet.
| |
| | |
| Solche elektronischen Anwendungen sind:
| |
| * Displays: [[Organischer Feldeffekttransistor|OFETs]], [[Organische Leuchtdiode|OLEDs]]
| |
| * [[RFID]]-Tags
| |
| * [[Solarzelle]]n
| |
| * [[Sensor]]en und [[Aktor]]en
| |
| * [[Brennstoffzelle]]n
| |
| * [[Lithium-Polymer-Akku]]s
| |
| * [[Elektrolytkondensator]]en
| |
| | |
| Eine andere Anwendung ist die ''Verarbeitung'' von Polymeren mit Hilfe der Elektronik beim [[Elektrospinnen]].
| |
| | |
| === Gesundheitliche Beurteilung ===
| |
| Polymere werden in der Regel als gesundheitlich unbedenklich eingestuft.<ref>{{BibISBN|9783642161735}}</ref><ref>[http://bfr.zadi.de/kse/faces/DBEmpfehlung.jsp Datenbank BfR-Empfehlungen zu Materialien für den Lebensmittelkontakt]. Abgerufen am 5. Dezember 2015.</ref> Kunststoffe können daher prinzipiell im medizinischen Bereich (bsp. als [[Implantat]]e) oder im Lebensmittelbereich (als [[Verpackung]]) eingesetzt werden. Es muss jedoch darauf geachtet werden, dass nur unbedenkliche [[Katalysator]]en bei der Herstellung verwendet werden, keine schädlichen [[Monomere]] zurückbleiben, etc.
| |
| | |
| == Supramolekulare Polymere ==
| |
| Ein relativ neuer Bereich der Polymerchemie umfasst [[Supramolekulare Chemie|supramolekulare]] Polymere, also Polymere, deren Bausteine nicht durch [[kovalente Bindung]]en, sondern durch vergleichsweise schwache intramolekulare Bindungen, wie etwa [[Wasserstoffbrückenbindung]]en, [[Ionenbindung]]en, [[Komplexchemie|Metall-Ligand-Wechselwirkungen]], [[Van-der-Waals-Kräfte|Van-der-Waals-]] oder [[Hydrophober Effekt|hydrophobe Wechselwirkungen]] zusammengehalten werden.<ref>T. F. A. de Greef, E. W. Meijer: ''Materials Science: Supramolecular Polymers''. In: ''Nature.'' 453, S. 171–173.</ref> Diese intramolekularen Bindungen können leicht zerbrochen werden (bei erhöhter Temperatur), können sich jedoch auch schnell wieder zurückbilden (beim Abkühlen). Aufgrund dieser Reversibilität zählen supramolekulare Polymere als neue Klasse selbstheilender Materialien.<ref>orf.at: [http://science.orf.at/stories/1681692/ Materialforschung – Selbstheilung durch Licht], abgerufen am 21. April 2011; Mark Burnworth, et al.:''Optically healable supramolecular polymers.'' in: Nature, Volume 472, S. 334–337, [[doi:10.1038/nature09963]]</ref> Eine weitere Folge der schwachen intramolekularen Bindungen ist die geringe Viskosität von Schmelzen supramolekularer Polymere, was bei der Herstellung und Verarbeitung von Vorteil sein kann, aber auch bei bestimmten Anwendungen, wie dem Tintenstrahldrucken.
| |
| | |
| Während kovalent gebundene Polymere eine große Rolle in der Natur spielen (DNA, Polypeptide, Cellulose), sind relativ wenige natürlich vorkommende supramolekulare Polymere bekannt. Ein Beispiel supramolekularer Polymerisation in der Natur ist die [[Selbstassemblierung]] des [[Tabakmosaikvirus]].
| |
| | |
| == Beispiele und Kurzzeichen ==
| |
| * Synthetische Polymere:
| |
| ** [[Polyethylen]] (PE)
| |
| ** [[Polypropylen]] (PP)
| |
| ** [[Polyvinylchlorid]] (PVC)
| |
| ** [[Polystyrol]] (PS), besser bekannt in geschäumtem Zustand als [[Styropor]]<sup>®</sup> (Handelsname der [[BASF]])
| |
| ** [[Polytetrafluorethylen]] (PTFE), Handelsname ist Teflon<sup>®</sup> (E. l. Du Pont de Nemours and Company) oder Tefal<sup>®</sup>
| |
| ** [[Polymethylmethacrylat]] (PMMA), unter dem Handelsnamen Plexiglas<sup>®</sup> ([[Evonik Industries AG]])
| |
| ** [[Polyacrylnitril]] (PAN), als Copolymer mit Polymethylmethacrylat zur Herstellung von Textilfasern
| |
| ** [[Polyacrylamid]] (PAA) als Gel(-Bildner), Flockungsmittel u. a.
| |
| ** die Gruppe der [[Polyamide]], als PA66 unter dem Handelsnamen Nylon<sup>®</sup>, als PA6 unter dem Handelsnamen [[Perlon]]<sup>®</sup> oder als PA12G unter dem Handelsnamen Lauramid<sup>®</sup>
| |
| ** die Gruppe der [[Aramide]] (Polyaramide, aromatische Polyamide), darunter die Textilfasern Poly(''p''-phenylenterephthalamid) (PPTA, Handelsnamen: Kevlar<sup>®</sup>, Twaron<sup>®</sup>) und Poly(''m''-phenylenterephthalamid) (PMPI, Handelsnamen: Nomex<sup>®</sup>, Teijinconex<sup>®</sup>)
| |
| ** Polyketone, wie [[Polyetherketone]] (PEK)
| |
| ** [[Polyester]], zu dieser Produktgruppe gehören auch
| |
| *** [[Polycarbonate]] (PC) mit Handelsnamen Lexan oder Makrolon<sup>®</sup> ([[Covestro]])
| |
| *** [[Polyethylenterephthalat]] (PET)
| |
| ** [[Polyethylenglycol]] (PEG)
| |
| ** die Gruppe der [[Polyurethane]] (PU)
| |
| ** [[Silikone]], genauer Poly(organo)siloxane
| |
| ** [[Melaminharz]] (MF), ein Polymer auf Basis von [[Melamin]] und [[Formaldehyd]]
| |
| * Biopolymere:
| |
| ** [[Protein]]e, wie [[Enzym]]e, [[Haar]]e, [[Seide]]
| |
| ** [[Kohlenhydrate]], wie [[Zellulose]], [[Holz]], [[Papier]], [[Stärke]], [[Chitin]]
| |
| ** [[Desoxyribonukleinsäure|DNS]], die Erbsubstanz
| |
| ** [[Ribonukleinsäure|RNS]]
| |
| ** [[Polyhydroxyalkanoate]], die Biopolyester als Energie- und Kohlenstoff-Speicher von Bakterien
| |
|
| |
|
| == Siehe auch == | | == Siehe auch == |
| * {{WikipediaDE|Kategorie:Polymer}}
| |
| * {{WikipediaDE|Polymer}}
| |
|
| |
|
| == Literatur ==
| | * {{WikipediaDE|Chemische Reaktion}} |
| * Manfred D. Lechner, Klaus Gehrke, Eckhard H. Nordmeier: ''Makromolekulare Chemie. Ein Lehrbuch für Chemiker, Physiker, Materialwissenschaftler und Verfahrenstechniker.'' 5. Auflage, Springer-Verlag, Berlin, Heidelberg 2014, ISBN 978-3-642-41768-9.
| | * {{WikipediaDE|Aktivierungsenergie}} |
| * J. Kahovec, R. B. Fox, K. Hatada: ''Nomenclature of regular single-strand organic polymers (IUPAC Recommendations 2002).'' In: ''Pure and Applied Chemistry.'' 74, 10, 2002, S. 1921–1956, [[doi:10.1351/pac200274101921]], [http://www.iupac.org/publications/pac/74/10/1921/ online-Fassung].
| | * {{WikipediaDE|Reaktionsenthalpie}} |
| * Ulf W. Gedde: ''Polymer Physics.'' Chapman & Hall, London u. a. 1995, ISBN 0-412-62640-3.
| |
| * H. Cherdron, F. Herold, A. Schneller: ''Technisch wichtige temperaturbeständige Polymere'', Chemie in unserer Zeit, 23. Jahrg. 1989, Nr. 6, S. 181–192, {{ISSN|0009-2851}}.
| |
| * Klaus Menke, Siegmar Roth: ''Metallisch leitfähige Polymere I und II'', Chemie in unserer Zeit, 20. Jahrg. 1986, Nr. 1, S. 1–10, Nr. 2, S. 33–43, {{ISSN|0009-2851}}. | |
| * {{Literatur|Autor=Michael Dröscher|Titel=Ordnungszustände in Polymeren|Sammelwerk=Chemie in unserer Zeit|Band=10|Nummer=4|Jahr=1976|Seiten=106–113|DOI=10.1002/ciuz.19760100403}} | |
| * {{Literatur|Autor=Dietrich Braun|Titel=Der lange Weg zum Makromolekül – Polymerforschung vor Hermann Staudinger|Sammelwerk=Chemie in unserer Zeit|Band=46|Nummer=5|Jahr=2012|Seiten=310–319|DOI=10.1002/ciuz.201200566}} | |
|
| |
|
| == Weblinks == | | == Einzelnachweise == |
| {{Wiktionary|Polymer}}
| |
| {{Commonscat|Polymers|Polymere}}
| |
| * [http://www.polymerelektronik.org/ VDMA-Polymerelektronik]
| |
| * [http://www.uni-ulm.de/oc2/uni_ulm_juni2002.htm Chemischer Hintergrund]
| |
| * [http://pslc.ws/macrog/index.htm Einführung und Ausblick in die Chemie der Polymere] (englisch)
| |
|
| |
|
| == Einzelnachweise ==
| |
| <references /> | | <references /> |
|
| |
|
| [[Kategorie:Polymer|!]] | | [[Kategorie:Chemie]] [[Kategorie:Biochemie]] |
| [[Kategorie:Kunststoff]] | |
| [[
| |
| | |
| {{Wikipedia}}
| |