Eine freie Initiative von Menschen bei mit online Lesekreisen, Übungsgruppen, Vorträgen ... |
| Use Google Translate for a raw translation of our pages into more than 100 languages. Please note that some mistranslations can occur due to machine translation. |
Anthropomorphismus und Chemische Bindung: Unterschied zwischen den Seiten
imported>Odyssee K (→Literatur) |
imported>Odyssee |
||
| Zeile 1: | Zeile 1: | ||
''' | Die '''chemische Bindung''' verbindet [[Atom]]e oder [[Ion]]en zu [[Molekül]]en bzw. [[Chemische Verbindung|chemischen Verbindungen]], die [[Energie|energetisch]] stabiler sind als die getrennten Bestandteile. Sie beruht auf der [[Wechselwirkung]] der [[Elektron]]en aus der äußersten [[Elektronenschale]] der an der Bindung beteiligten Atome. | ||
== Grundlagen == | |||
Atome bestehen nach heutiger [[naturwissenschaft]]licher Sicht aus einem elektrisch positiv geladenen [[Atomkern]] und einer Hülle aus negativ geladenen [[Elektron]]en. Als Teilchen mit halbzahligen [[Spin]] sind sie nach den Gesetzen der [[Quantentheorie]] sogenannte [[Fermionen]], die dem [[Pauli-Prinzip]] unterliegen, nach dem die Elektronen der Hülle nicht in allen Quantenzahlen übereinstimmen dürfen. Sie können sich daher nicht im untersten, energieärmsten Niveau zusammendrängen, sondern müssen sich auch auf höhere, ausgedehntere und energiereichere [[Elektronenschale]]n bzw. [[Atomorbital]]e verteilen. Sie bedingen dadurch die relativ große räumliche Ausdehnung der Elektronenhülle, die den Atomkern um das 20.000- bis 150.000-fache übertrifft. Die Elektronen der äußersten Schale, der sogenannten [[Valenzschale]], bestimmen die [[Chemie|chemische Eigenschaften]] eines Atoms und seine Stellung im [[Periodensystem der chemischen Elemente]]. | |||
im | |||
[[Datei:H2O 2D labelled.svg|mini|150px|Bindungslängen und Bindungswinkel des Wassermoleküls (H<sub>2</sub>O)]] | |||
Die Valenzschale erreicht ihren energetisch stabilsten Zustand, wenn sie mit der maximal möglichen Zahl von Elektronen vollständig aufgefüllt ist. Das ist aber nur bei den [[Edelgase]]n der Fall, die entsprechend reaktionsträge sind, da sie ihren stabilsten Zustand bereits erreicht haben. Atome mit unvollständig aufgefüllter Valenzschale können sich dadurch stabilisieren, dass sie solange von ihren Bindungspartnern Elektronen aufnehmen oder an diese abgeben, bis sie eine vollkommen abgeschlossene Außenschale erreicht haben. Die so aneinander gebunden Atome erreichen damit gemeinsam ihren stabilsten, energieärmsten Zustand. Nach der von [[w:Gilbert Newton Lewis|Gilbert Newton Lewis]] und [[w:Walther Kossel|Walther Kossel]] 1916 formulierten '''Edelgasregel''' sind chemische Verbindungen besonders stabil, wenn die daran beteiligten Atome die im [[Periodensystem]] nächstgelegene '''Edelgaskonfiguration''' ausbilden können. Mit Ausnahme des [[Helium]]s haben die Edelgase 8 Außenelektronen. Nach der darauf basierenden '''Oktettregel''' sind Verbindungen besonders stabil, wenn die gebundenen Atome dadurch 8 Elektronen haben und dadurch der Edelgaskonfiguration entsprechen. | |||
und des | |||
der | |||
der | |||
die | |||
und | |||
= | Um eine chemische Bindung wieder zu spalten, muss eine entsprechende '''Bindungsenergie''' aufgewendet werden, die man meist in [[Joule]] pro [[Mol]] angibt. Die '''Bindungslänge''' ergibt sich aus dem von [[Atomkern]] zu Atomkern gemessene Abstand der aneinander gebundenen Atome. Bei [[kristall]]inen [[Feststoff]]en kann sie experimentell durch [[Kristallstrukturanalyse]] ermittel werden und liegt bei kovalenten Bindungen je nach den beteiligten Atomsorten typischerweise zwischen etwa 75 und 250 [[Pikometer|pm]] (1 pm = 10<sup>−12</sup> m). Auf diesem Weg lassen sich auch die '''Bindungswinkel''' zwischen den einzelnen Bindungen eines [[Molekül]]s ermitteln. Bindungslängen und Bindungswinkel bestimmen die [[Molekülgeometrie]], die sich durch entsprechende [[Strukturformel]]n veranschaulichen lässt. | ||
< | === Elektronegativität === | ||
Eine relatives Maß für die Fähigkeit von Atomen, Elektronen zur Auffüllung ihrer Valenzschale an sich zu ziehen, bietet das 1932 von [[w:Linus Pauling|Linus Pauling]] (1901-1994) eingeführte Konzept der '''Elektronegativität''' (kurz: '''EN'''; Formelzeichen <math>\chi</math>). Atome mit nahezu vollständig gesättigter Valenzschale, wie etwa die [[Halogene]], nehmen sehr leicht Elektronen auf und haben eine entsprechend hohe Elektronegativität. Atome mit nur wenigen Außenelektronen, wie etwa die [[Alkalimetalle]], geben diese leicht an ihre Bindungspartner ab und haben daher eine geringe Elektronegativität. | |||
== Bindungsarten == | |||
Auf rein [[physisch]]er Ebene entsprechen die drei Grundtypen der chemischen Bindung den [[Tria Principia]] des [[Paracelsus]]<ref>Gutmann/Hengge, S. 3</ref>: | |||
* [[Sal]] entspricht der salzartigen [[#Ionische Bindung|ionischen Bindung]], | |||
* [[Mercurius]] der [[#Metallische Bindung|metallischen Bindung]], | |||
* [[Sulphur]] der [[#Kovalente Bindung|kovalenten Bindung]] | |||
=== Ionische Bindung === | |||
[[Datei:NaCl polyhedra.png|mini|200px|Ausschnitt aus der kubischen Kristallstruktur des [[w:Natriumchlorid|Natriumchlorid]]s.]] | |||
Die '''ionische Bindung''' (auch: '''Ionenbindung''') entsteht zwischen [[Chemische Elemente|chemischen Elementen]], deren Atome sich stark in ihrer [[#Elektronegativität|Elektronegativität]] unterscheiden. Das Atom mit der geringeren Elektronegativität gibt dadurch sehr leicht seine Außenelektronen an das elektronegativere Atom ab und wird dadurch wegen der nun überwiegenden Kernladung zu einem ein- oder mehrfach positiv geladenen [[Kation]]. Im Gegenzug erhält das elektronegativere Atom eine negative Überschussladung und wird dadurch in gleichem Maß zu einem negativ geladenen [[Anion]]. Die gegensätzlich geladenen [[Ion]]en werden durch die [[Elektrostatik|elektrostatische Anziehung]] fest aneinander gebunden und fügen sich in ein regelmäßig geordnetes [[Kristallgitter]] ein. Dadurch entstehen [[Salze|salzartige]], meist schwer schmelzbarer '''Ionenkristalle''', die die Grundlage der [[Mineralwelt]] bilden. Ein typisches Beispiel ist das aus [[Natrium]] und [[Chlor]] gebildete [[Natriumchlorid]] (NaCl), das als [[Kochsalz]] wohlbekannt ist. Jedes Na<sup>+</sup>-Ion (grau) ist von 6 [[Oktaeder|oktaedrisch]] angeordneten Cl<sup>-</sup>-Ionen (grün) umgeben, von denen jedes wiederum von 6 Na<sup>+</sup>-Ionen umgeben ist. Die Anzahl der nächsten Nachbarn im Kristallgitter, die hier für beiden Ionensorten 6 beträgt, wird als '''Koordinationszahl''' (KZ) bezeichnet. Das '''Koordinationspolyeder''' ist jeweils ein [[Oktaeder]] (siehe Zeichnung). | |||
=== Kovalente Bindung === | |||
Die '''kovalente Bindung''' (veraltet auch '''Atombindung''', '''Elektronenpaarbindung''' oder '''homöopolare Bindung'''), wie sie vor allem für [[organische Verbindung]]en typisch ist, entsteht zwischen Atomen mit gleicher oder vergleichbarer Elektronegativität. Eine Ionenbindung kann in diesem Fall nicht entstehen, statt dessen teilen die beteiligten Atome ein oder mehrere bindende Elektronenpaare und bilden durch Überlagerung der an der Bindung beteiligten zwei [[Atomorbital]]e ein gemeinsames bindendes und ein antibindendes '''Molekülorbital''' ('''MO''') aus, wobei aber nur das energetisch tiefer liegende bindende Molekülorbital von den beiden bindenden Elektronen besetzt wird. Die Atome werden dadurch zu einem [[Molekül]] verbunden. So verwandelt sich etwa der hochreaktive atomare [[Wasserstoff]] (H), der z.B. durch die Reaktion unedeler [[Metalle]] mit [[Säuren]] entsteht, praktisch augenblicklich in das wesentlich stabilere Wasserstoffmolekül (H<sub>2</sub>) um. Auch [[Stickstoff]] (N) und [[Sauerstoff]] (O) kommen in der [[Luft]] niemals in atomarer, sondern stets nur in molekularer Form vor, d.h. als N<sub>2</sub> bzw. O<sub>2</sub>. Schon [[w:Amadeo Avogadro|Amadeo Avogadro]] (1776-1856) unterschied zwischen Atomen (''molécules élémentaires'') und Molekülen (''molécules intégrantes'') und vermutete, dass die [[Chemische Elemente|chemischen Elemente]] in der Gasphase nicht als einzelne Atome, sondern als zweiatomige Moleküle vorliegen. Seine Ansichten gerieten aber für längere Zeit in Vergessenheit. Erst seinem Schüler [[Wikipedia:Stanislao Cannizzaro|Stanislao Cannizzaro]] (1826-1910) gelang der Nachweis, dass [[Wasserstoff]] im Gaszustand als H<sub>2</sub>-Molekül vorliegt. | |||
<center><gallery widths="150px" heigths="150px" caption="Die Molekülorbitale des Wasserstoffmoleküls H<sub>2</sub>"> | |||
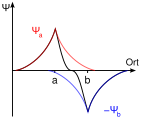
Wave functions binding.svg|Additive Überlagerung der Wellenfunktionen (bindend) | |||
Dihydrogen-HOMO-phase-3D-balls.svg|Bindendes Molekülorbital | |||
Wave functions anti-binding.svg|Subtraktive Überlagerung der Wellenfunktion (antibindend) | |||
Dihydrogen-LUMO-phase-3D-balls.png|Antibindendes Molekülorbital | |||
Wasserstoff-Orbitale.svg|Besetzungsschema der Molekülorbitale | |||
</gallery></center> | |||
[[Quantenmechanik|Quantenmechanisch]] lassen sich Atombindungen näherungsweise durch die [[1927]] von [[w:Walter Heitler|Walter Heitler]] und [[w:Fritz London|Fritz London]] entwickelte [[w:Valenzstrukturtheorie|Valenzstrukturtheorie]] (VB-Theorie) oder durch die wenig später von [[w:Friedrich Hund|Friedrich Hund]] und [[w:Robert S. Mulliken|Robert S. Mulliken]] aufgestellte [[w:Molekülorbitaltheorie|Molekülorbitaltheorie]] (MO-Theorie)berechnen. | |||
[[Datei:Ch4 hybridization.svg|mini|Die 4 bindenden sp<sup>3</sup>-[[Hybridorbitale]] von [[w:Methan|Methan]] (CH<sub>4</sub>), durch die 4 Wasserstoffatome kovalent an das zentrale Kohlenstoffatom gebunden sind.]] | |||
Um die [[Molekülgeometrie|geometrischen Verhältnisse]] bei Atombindungen wirklichkeitsgetreuer zu beschreiben, führte [[w:Linus Pauling|Linus Pauling]] um 1931 das Konzept der [[Hybridorbitale]] ein. Er nützte dabei die Tatsache aus, dass alle Linearkombinationen der [[Wellenfunktion]]en, die sich als Lösungen der [[Schrödingergleichung]] ergeben, gültige Lösungen derselben sind. | |||
Ein Beispiel möge dies verdeutlichen: Ein [[Kohlenstoff]]atom (C) verbindet sich mit vier [[Wasserstoff]]atomen (H) zu dem [[Kohlenwasserstoff]] [[w:Methan|Methan]] (CH<sub>4</sub>). Wasserstoff verfügt nur über ein einziges Elektron, das sich im Grundzustand im 1s-Orbital aufhält. Kohlenstoff hat insgesamt 6 Elektronen, von denen sich zwei in der inneren 1s-Schale befinden, die an der Bindung unbeteiligt ist. Die restlichen 4 Elektronen befinden sich in der 2. Schale und verteilen sich auf das kugelsymmetrische 2s-Orbital und die drei hantelförmigen 2p-Orbitale, d.h. auf 2p<sub>x</sub>, 2p<sub>y</sub> und 2p<sub>z</sub>, die rechtwinkelig zueinander stehen. Da die [[kovalente Bindung]] der 4 Wasserstoffatome an den Kohlenstoff durch Überlagerung der äußeren Atomorbitale erfolgt, müssten theoretisch unterschiedliche Bindungen entstehen je nach dem, ob sich das 1s-Orbital des Wasserstoffs mit dem 2s-Orbital oder einem der drei 2p-Orbitale des Kohlenstoffs überlagert. Empirisch zeigt sich allerdings, dass alle 4 Bindungen völlig gleichwertig und nach den Ecken eines [[Tetraeder]]s ausgerichtet sind. Das Problem lässt sich lösen, wenn man das 2s-Orbital und die drei 2p-Orbitale durch Linearkombination zu vier gleichwertigen sp<sup>3</sup>-Hybridorbitalen umwandelt, die tetraedrisch ausgerichtet und mit je einem Elektron besetzt sind. | |||
Unterscheiden sich die Elektronegativitäten der Bindungspartner voneinander, entsteht eine '''polare Atombindung''', bei der sich die miteinander verbunden Atome zwar nicht zu [[Ion]]en verwandeln, aber doch positive und negative Partialladungen tragen. | |||
==== Koordinative Bindung ==== | |||
Die '''koordinative Bindung''' (auch '''Donator-Akzeptor-Bindung''' oder veraltet '''dative Bindung''') ist eine besondere Form der Elektronenpaarbindung, bei der das bindende Elektronenpaar allein von einem der beiden Bindungspartner (dem ''Donator'') bereitgestellt wird. Sie bildet die Grundlage der '''Komplexchemie'''. Die koordinativ an das '''Zentralatom''' gebundenen Atome, Ionen oder Moleküle werden als '''Liganden''' (von [[lat.]] ''ligare'' „binden“) bezeichnet. Als Zentralatome kommen vor allem [[Metalle]] infrage, die über freie [[d-Orbital]]e verfügen, wie etwa [[Kupfer|Cu<sup>2+</sup>]], [[Magnesium|Mg<sup>2+</sup>]], [[Eisen|Fe<sup>2+</sup>]], [[Eisen|Fe<sup>3+</sup>]], [[Eisen|Fe<sup>0</sup>]], [[Chrom|Cr<sup>0</sup>]], [[Nickel|Ni<sup>2+</sup>]] und [[Nickel|Ni<sup>0</sup>]]. | |||
So sind etwa die vier [[w:Ammoniak|Ammoniak]]-Moleküle (NH<sub>3</sub>) in dem tiefblauen [[w:Tetraamminkupfersulfat|Tetraamminkupfer(II)-sulfat]] [Cu(NH<sub>3</sub>)<sub>4</sub>]SO<sub>4</sub> koordinativ über das einsame Elektronenpaar des [[Stickstoff]]s an das zentrale Kupferatom gebunden. | |||
{| align="center" | | |||
|- | |||
| [[Datei:Tetraamminkupfer Kation.svg|120px|]][[Datei:Sulfat-Ion2.svg|90px]] | |||
|} | |||
[[Datei:Nuvola di elettroni.svg|mini|Ein Metallgitter aus positiv geladenen Atomrümpfen, die von frei beweglichen Elektronen umgeben sind.]] | |||
Auf ähnliche Weise ist auch das [[Kristallwasser]] in dem blauen [[w:Kupfersulfat|Kupfersulfat-Pentahydrat]] Cu[SO<sub>4</sub>]·5H<sub>2</sub>O und ähnlichen [[Salze]]n koordinativ gebunden. Treibt man das Kristallwasser durch Erhitzen aus, bleibt das kristallwasserfrei farblos weißliche Kupfersulfat CuSO<sub>4</sub> zurück. | |||
=== Metallische Bindung === | |||
[[Metalle]] haben nur relativ wenige Außenelektronen und geben diese auch ohne Reaktionspartner leicht ab. Dadurch entstehen leicht bewegliche freie Elektronen, die den Metallen ihre hohe [[Elektrische Leitfähigkeit|elektrische]] und [[Wärmeleitung|thermische Leitfähigkeit]] verleiht. | |||
== Siehe auch == | |||
* {{WikipediaDE|Chemische Bindung}} | |||
* {{WikipediaDE|Ionische Bindung}} | |||
* {{WikipediaDE|Kovalente Bindung}} | |||
* {{WikipediaDE|Metallische Bindung}} | |||
* {{WikipediaDE|Van-der-Waals-Kräfte}} | |||
* {{WikipediaDE|Wasserstoffbrückenbindung}} | |||
== Literatur == | == Literatur == | ||
* [[Viktor Gutmann]], Edwin Hengge: ''Allgemeine und anorganische Chemie'', 5. Auflage, Verlag Chemie, Weinheim 1990, ISBN 978-3527281596 | |||
* A. F. Holleman, E. Wiberg, N. Wiberg: ''Lehrbuch der Anorganischen Chemie'', 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 | |||
* K. P. C. Vollhardt, Neil E. Schore, Holger Butenschön (Hrsg.): ''Organische Chemie'', 5. Auflage, Wiley-VCH 2011, ISBN 978-3527327546 | |||
* Paula Y. Bruice: ''Organische Chemie: Studieren kompakt'', 5. Auflage, Pearson Studium 2011, ISBN 978-3868941029, eBook {{ASIN|B00QV6QM0O}} | |||
== Einzelnachweise == | |||
<references /> | |||
[[Kategorie: | [[Kategorie:Chemie]] | ||
Version vom 1. Januar 2019, 15:53 Uhr
Die chemische Bindung verbindet Atome oder Ionen zu Molekülen bzw. chemischen Verbindungen, die energetisch stabiler sind als die getrennten Bestandteile. Sie beruht auf der Wechselwirkung der Elektronen aus der äußersten Elektronenschale der an der Bindung beteiligten Atome.
Grundlagen
Atome bestehen nach heutiger naturwissenschaftlicher Sicht aus einem elektrisch positiv geladenen Atomkern und einer Hülle aus negativ geladenen Elektronen. Als Teilchen mit halbzahligen Spin sind sie nach den Gesetzen der Quantentheorie sogenannte Fermionen, die dem Pauli-Prinzip unterliegen, nach dem die Elektronen der Hülle nicht in allen Quantenzahlen übereinstimmen dürfen. Sie können sich daher nicht im untersten, energieärmsten Niveau zusammendrängen, sondern müssen sich auch auf höhere, ausgedehntere und energiereichere Elektronenschalen bzw. Atomorbitale verteilen. Sie bedingen dadurch die relativ große räumliche Ausdehnung der Elektronenhülle, die den Atomkern um das 20.000- bis 150.000-fache übertrifft. Die Elektronen der äußersten Schale, der sogenannten Valenzschale, bestimmen die chemische Eigenschaften eines Atoms und seine Stellung im Periodensystem der chemischen Elemente.

Die Valenzschale erreicht ihren energetisch stabilsten Zustand, wenn sie mit der maximal möglichen Zahl von Elektronen vollständig aufgefüllt ist. Das ist aber nur bei den Edelgasen der Fall, die entsprechend reaktionsträge sind, da sie ihren stabilsten Zustand bereits erreicht haben. Atome mit unvollständig aufgefüllter Valenzschale können sich dadurch stabilisieren, dass sie solange von ihren Bindungspartnern Elektronen aufnehmen oder an diese abgeben, bis sie eine vollkommen abgeschlossene Außenschale erreicht haben. Die so aneinander gebunden Atome erreichen damit gemeinsam ihren stabilsten, energieärmsten Zustand. Nach der von Gilbert Newton Lewis und Walther Kossel 1916 formulierten Edelgasregel sind chemische Verbindungen besonders stabil, wenn die daran beteiligten Atome die im Periodensystem nächstgelegene Edelgaskonfiguration ausbilden können. Mit Ausnahme des Heliums haben die Edelgase 8 Außenelektronen. Nach der darauf basierenden Oktettregel sind Verbindungen besonders stabil, wenn die gebundenen Atome dadurch 8 Elektronen haben und dadurch der Edelgaskonfiguration entsprechen.
Um eine chemische Bindung wieder zu spalten, muss eine entsprechende Bindungsenergie aufgewendet werden, die man meist in Joule pro Mol angibt. Die Bindungslänge ergibt sich aus dem von Atomkern zu Atomkern gemessene Abstand der aneinander gebundenen Atome. Bei kristallinen Feststoffen kann sie experimentell durch Kristallstrukturanalyse ermittel werden und liegt bei kovalenten Bindungen je nach den beteiligten Atomsorten typischerweise zwischen etwa 75 und 250 pm (1 pm = 10−12 m). Auf diesem Weg lassen sich auch die Bindungswinkel zwischen den einzelnen Bindungen eines Moleküls ermitteln. Bindungslängen und Bindungswinkel bestimmen die Molekülgeometrie, die sich durch entsprechende Strukturformeln veranschaulichen lässt.
Elektronegativität
Eine relatives Maß für die Fähigkeit von Atomen, Elektronen zur Auffüllung ihrer Valenzschale an sich zu ziehen, bietet das 1932 von Linus Pauling (1901-1994) eingeführte Konzept der Elektronegativität (kurz: EN; Formelzeichen ). Atome mit nahezu vollständig gesättigter Valenzschale, wie etwa die Halogene, nehmen sehr leicht Elektronen auf und haben eine entsprechend hohe Elektronegativität. Atome mit nur wenigen Außenelektronen, wie etwa die Alkalimetalle, geben diese leicht an ihre Bindungspartner ab und haben daher eine geringe Elektronegativität.
Bindungsarten
Auf rein physischer Ebene entsprechen die drei Grundtypen der chemischen Bindung den Tria Principia des Paracelsus[1]:
- Sal entspricht der salzartigen ionischen Bindung,
- Mercurius der metallischen Bindung,
- Sulphur der kovalenten Bindung
Ionische Bindung

Die ionische Bindung (auch: Ionenbindung) entsteht zwischen chemischen Elementen, deren Atome sich stark in ihrer Elektronegativität unterscheiden. Das Atom mit der geringeren Elektronegativität gibt dadurch sehr leicht seine Außenelektronen an das elektronegativere Atom ab und wird dadurch wegen der nun überwiegenden Kernladung zu einem ein- oder mehrfach positiv geladenen Kation. Im Gegenzug erhält das elektronegativere Atom eine negative Überschussladung und wird dadurch in gleichem Maß zu einem negativ geladenen Anion. Die gegensätzlich geladenen Ionen werden durch die elektrostatische Anziehung fest aneinander gebunden und fügen sich in ein regelmäßig geordnetes Kristallgitter ein. Dadurch entstehen salzartige, meist schwer schmelzbarer Ionenkristalle, die die Grundlage der Mineralwelt bilden. Ein typisches Beispiel ist das aus Natrium und Chlor gebildete Natriumchlorid (NaCl), das als Kochsalz wohlbekannt ist. Jedes Na+-Ion (grau) ist von 6 oktaedrisch angeordneten Cl--Ionen (grün) umgeben, von denen jedes wiederum von 6 Na+-Ionen umgeben ist. Die Anzahl der nächsten Nachbarn im Kristallgitter, die hier für beiden Ionensorten 6 beträgt, wird als Koordinationszahl (KZ) bezeichnet. Das Koordinationspolyeder ist jeweils ein Oktaeder (siehe Zeichnung).
Kovalente Bindung
Die kovalente Bindung (veraltet auch Atombindung, Elektronenpaarbindung oder homöopolare Bindung), wie sie vor allem für organische Verbindungen typisch ist, entsteht zwischen Atomen mit gleicher oder vergleichbarer Elektronegativität. Eine Ionenbindung kann in diesem Fall nicht entstehen, statt dessen teilen die beteiligten Atome ein oder mehrere bindende Elektronenpaare und bilden durch Überlagerung der an der Bindung beteiligten zwei Atomorbitale ein gemeinsames bindendes und ein antibindendes Molekülorbital (MO) aus, wobei aber nur das energetisch tiefer liegende bindende Molekülorbital von den beiden bindenden Elektronen besetzt wird. Die Atome werden dadurch zu einem Molekül verbunden. So verwandelt sich etwa der hochreaktive atomare Wasserstoff (H), der z.B. durch die Reaktion unedeler Metalle mit Säuren entsteht, praktisch augenblicklich in das wesentlich stabilere Wasserstoffmolekül (H2) um. Auch Stickstoff (N) und Sauerstoff (O) kommen in der Luft niemals in atomarer, sondern stets nur in molekularer Form vor, d.h. als N2 bzw. O2. Schon Amadeo Avogadro (1776-1856) unterschied zwischen Atomen (molécules élémentaires) und Molekülen (molécules intégrantes) und vermutete, dass die chemischen Elemente in der Gasphase nicht als einzelne Atome, sondern als zweiatomige Moleküle vorliegen. Seine Ansichten gerieten aber für längere Zeit in Vergessenheit. Erst seinem Schüler Stanislao Cannizzaro (1826-1910) gelang der Nachweis, dass Wasserstoff im Gaszustand als H2-Molekül vorliegt.
- Die Molekülorbitale des Wasserstoffmoleküls H<sub
-
Additive Überlagerung der Wellenfunktionen (bindend)
-
Bindendes Molekülorbital
-
Subtraktive Überlagerung der Wellenfunktion (antibindend)
-
Antibindendes Molekülorbital
-
Besetzungsschema der Molekülorbitale
Quantenmechanisch lassen sich Atombindungen näherungsweise durch die 1927 von Walter Heitler und Fritz London entwickelte Valenzstrukturtheorie (VB-Theorie) oder durch die wenig später von Friedrich Hund und Robert S. Mulliken aufgestellte Molekülorbitaltheorie (MO-Theorie)berechnen.

Um die geometrischen Verhältnisse bei Atombindungen wirklichkeitsgetreuer zu beschreiben, führte Linus Pauling um 1931 das Konzept der Hybridorbitale ein. Er nützte dabei die Tatsache aus, dass alle Linearkombinationen der Wellenfunktionen, die sich als Lösungen der Schrödingergleichung ergeben, gültige Lösungen derselben sind.
Ein Beispiel möge dies verdeutlichen: Ein Kohlenstoffatom (C) verbindet sich mit vier Wasserstoffatomen (H) zu dem Kohlenwasserstoff Methan (CH4). Wasserstoff verfügt nur über ein einziges Elektron, das sich im Grundzustand im 1s-Orbital aufhält. Kohlenstoff hat insgesamt 6 Elektronen, von denen sich zwei in der inneren 1s-Schale befinden, die an der Bindung unbeteiligt ist. Die restlichen 4 Elektronen befinden sich in der 2. Schale und verteilen sich auf das kugelsymmetrische 2s-Orbital und die drei hantelförmigen 2p-Orbitale, d.h. auf 2px, 2py und 2pz, die rechtwinkelig zueinander stehen. Da die kovalente Bindung der 4 Wasserstoffatome an den Kohlenstoff durch Überlagerung der äußeren Atomorbitale erfolgt, müssten theoretisch unterschiedliche Bindungen entstehen je nach dem, ob sich das 1s-Orbital des Wasserstoffs mit dem 2s-Orbital oder einem der drei 2p-Orbitale des Kohlenstoffs überlagert. Empirisch zeigt sich allerdings, dass alle 4 Bindungen völlig gleichwertig und nach den Ecken eines Tetraeders ausgerichtet sind. Das Problem lässt sich lösen, wenn man das 2s-Orbital und die drei 2p-Orbitale durch Linearkombination zu vier gleichwertigen sp3-Hybridorbitalen umwandelt, die tetraedrisch ausgerichtet und mit je einem Elektron besetzt sind.
Unterscheiden sich die Elektronegativitäten der Bindungspartner voneinander, entsteht eine polare Atombindung, bei der sich die miteinander verbunden Atome zwar nicht zu Ionen verwandeln, aber doch positive und negative Partialladungen tragen.
Koordinative Bindung
Die koordinative Bindung (auch Donator-Akzeptor-Bindung oder veraltet dative Bindung) ist eine besondere Form der Elektronenpaarbindung, bei der das bindende Elektronenpaar allein von einem der beiden Bindungspartner (dem Donator) bereitgestellt wird. Sie bildet die Grundlage der Komplexchemie. Die koordinativ an das Zentralatom gebundenen Atome, Ionen oder Moleküle werden als Liganden (von lat. ligare „binden“) bezeichnet. Als Zentralatome kommen vor allem Metalle infrage, die über freie d-Orbitale verfügen, wie etwa Cu2+, Mg2+, Fe2+, Fe3+, Fe0, Cr0, Ni2+ und Ni0.
So sind etwa die vier Ammoniak-Moleküle (NH3) in dem tiefblauen Tetraamminkupfer(II)-sulfat [Cu(NH3)4]SO4 koordinativ über das einsame Elektronenpaar des Stickstoffs an das zentrale Kupferatom gebunden.
 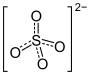
|

Auf ähnliche Weise ist auch das Kristallwasser in dem blauen Kupfersulfat-Pentahydrat Cu[SO4]·5H2O und ähnlichen Salzen koordinativ gebunden. Treibt man das Kristallwasser durch Erhitzen aus, bleibt das kristallwasserfrei farblos weißliche Kupfersulfat CuSO4 zurück.
Metallische Bindung
Metalle haben nur relativ wenige Außenelektronen und geben diese auch ohne Reaktionspartner leicht ab. Dadurch entstehen leicht bewegliche freie Elektronen, die den Metallen ihre hohe elektrische und thermische Leitfähigkeit verleiht.
Siehe auch
- Chemische Bindung - Artikel in der deutschen Wikipedia
- Ionische Bindung - Artikel in der deutschen Wikipedia
- Kovalente Bindung - Artikel in der deutschen Wikipedia
- Metallische Bindung - Artikel in der deutschen Wikipedia
- Van-der-Waals-Kräfte - Artikel in der deutschen Wikipedia
- Wasserstoffbrückenbindung - Artikel in der deutschen Wikipedia
Literatur
- Viktor Gutmann, Edwin Hengge: Allgemeine und anorganische Chemie, 5. Auflage, Verlag Chemie, Weinheim 1990, ISBN 978-3527281596
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1
- K. P. C. Vollhardt, Neil E. Schore, Holger Butenschön (Hrsg.): Organische Chemie, 5. Auflage, Wiley-VCH 2011, ISBN 978-3527327546
- Paula Y. Bruice: Organische Chemie: Studieren kompakt, 5. Auflage, Pearson Studium 2011, ISBN 978-3868941029, eBook ASIN B00QV6QM0O
Einzelnachweise
- ↑ Gutmann/Hengge, S. 3